
Kimyasal Tepkimelerde Enerji, Hız ve Denge AYT Kimya Kimyatik YouTube
#matematik#kimya#biyoloji#geometri#fizik#edebiyat#tarih#rehberlikPDF : https://drive.google.com/file/d/1UYOEsSWwhKBEz4d3G6d_Y8VhYNLE0gM2/view?usp=sharingKANA.
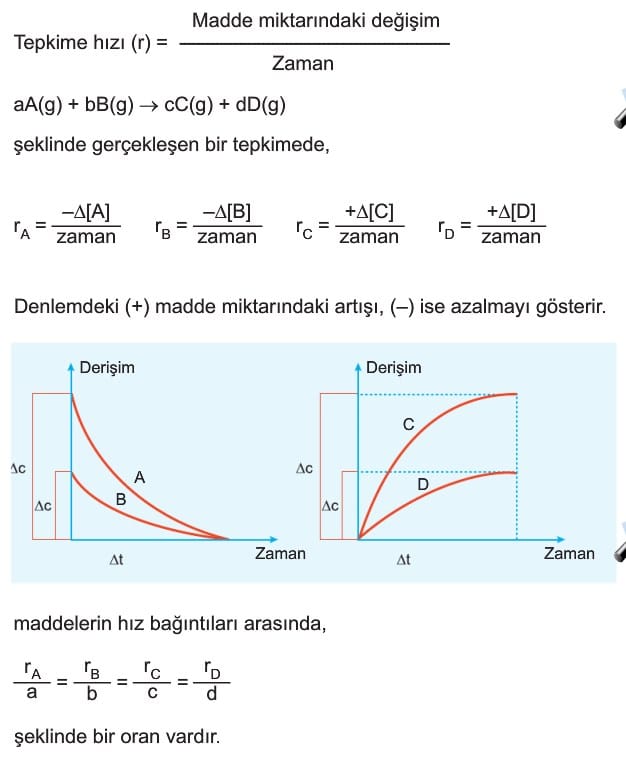
Tepkime Hızları Konu Anlatımı soruları çözümleri 11. sınıf kimya özet
Bu modül, kimyasal tepkimelerde hız kontrolünü, denge kontrolünü ve kimyasal tepkimelerde çözünürlük dengeleri kontrolünü kuralına uygun yapabilme ile ilgili bilgi ve becerilerin kazandırıldığı bir öğrenme materyalidir. SÜRE 40/32 ÖN KOġUL YETERLĠK Kimyasal tepkimelerde hız ve denge kontrolü yapmak MODÜLÜN AMACI

Kimyasal Tepkimelerde Denge Ünitesi Kimya
Denklemi n A + m B → p P + q Q şeklinde olan tek basamaklı bir kimyasal tepkime için hız eşitliği aşağıdaki gibi yazılır. Burada k hız sabitidir. Hız denklemi yazılırken sadece gaz ve çözelti ( aqua) halindeki girenler yazılır. Çünkü katı ve sıvıların molariteleri sabittir. Çok basamaklı tepkimeler

AYT Kimya Konu Anlatım Modülleri Modül 3 Kimyasal Tepkimelerde Enerji Kimyasal Tepkimelerde Hız
Kimyasal Tepkimelerde Hız, Endotermik Tepkimeler, Ekzotermik Tepkimeler, Hız Tayini, Çarpışma Kuramı, Hız Tayini, Hızı Etkileyen Faktörler, Katalizör.

AYT Kimya 11. Sınıf Ders İşleyiş Modülleri Modül6 Kimyasal Tepkimelerde Hız Nesibe Aydın
Tepkime Hızları İçindekiler [ göster] " Tepkime hızları ", tepkimelerin başladıktan sonraki hızları ile ilgili bir kavramdır. Bazı tepkimeler çok hızlı gerçekleşirken, bazıları çok yavaştır. Hava yastıklarının açılması veya bombaların patlaması gibi bazı kimyasal tepkimeler başladıkları anda biterler.

Kimyasal Tepkimelerde Hız Bölüm 3 YouTube
KİMYASAL TEPKİMELERDE HIZ KONU ANLATIMI - Yepyeni - Müfredata uygun - Anlaşılır - Pratik - Akılda kalıcı - KİMYA BİLMEK İSTEYENLERİN TERCİHİ :)KİMYASAL TEPKİ.

AYT Kimya Konu Anlatım Modülleri Modül 3 Kimyasal Tepkimelerde Enerji Kimyasal Tepkimelerde Hız
Hız denkleminde yer alan maddenin derişimi arttıkça hız artar Derişim hız sabitini (k) etkilemez. Sayısal yorumlama hız denklemi olmadan ya-pılamaz. [N2] [H2] Tepkime Hızı 2 Kat Sabit Sabit 2 Kat 1/2 Kat 2 Kat 4 kat 1/2 Kat N 2(g) + 3 H 2(g) g 2NH 3(g) tepkimesi için aşağıdaki tabloyu tamamlayalım; 2010 2013 2018 2021 2011

Mavi ders ALİ KARAGÖZ KİMYASAL TEPKİMELERDE ENERJİ
Kimyasal reaksiyonların hızlarını ölçen, mekanizmalarını inceleyen kimya dalına. kimyasal kinetik denir. 1.1. Tepkime Hızlarının İncelenmesi. A (g) + B (g) → C (g) + D (g) gibi kimyasal tepkimelerde, tepkime süresince girenlerin miktarı azalırken ürünlerin miktarı artar. Bu artma ve azalma ne kadar hızlı oluyorsa tepkime.

Kimyasal Tepkimelerde Hız Soru Çözümü 1 YouTube
1. Kimyasal Denge İçindekiler [ göster] "Kimyasal Denge" konusu, denge tepkimelerini anlamamızı sağlayan bir konudur. "Denge Tepkimeleri", bir çeşit tepkime türü değildir. Tepkimelerin gerçekleşme tarzı ile ilgili bir özelliktir. Yani, her kimyasal tepkime, aynı zamanda bir denge tepkimesi olabilir. Denge Tepkimesinin Temel Farkı

Kimyasal Tepkimelerde Hız Deneyleri ( Öğrenme garantili) YouTube
Konuyu Pekiştirmeyi Unutma 👇Kimyada Çözmediğin Soru Kalmasın👉 http://bit.ly/3UzaxTJDers Notların (8 Sayfa) 👉 https://bit.ly/3ZXZPr0Ders Notların (2.

Kimyasal tepkimelerde hız DonanımHaber Forum
11.Sınıf Kimya 6. Ünite Kimyasal Tepkimelerde Denge Ders Notları-Test Soruları Ve Cevapları. 11.Sınıf Kimya Kimyasal Tepkimelerde Enerji Konu Anlatımı Ve Sorular. 11.Sınıf Kimya Kimyasal Tepkimelerde Elektrik Konu Anlatımı Ve Sorular. 11.Sınıf Kimya Kimyasal Tepkimelerde Denge Konu Anlatımı Sorular Ve Cevaplar.

Kimyasal Tepkimelerde Hız (5) YouTube
Kimyasal Denge. Kimyasal denge, iki yönlü bir tepkimede ürünlerin meydana geliş hızının, ürünlerden tekrar tepkimeye girenlerin meydana geliş hızına eşit olduğu durumdur. Böyle denklemlerde tepkimenin her iki tarafa olabileceğini göstermek için çift yönlü ok" ↔" kullanılır. Genel olarak şöyle göstermek mümkündür:

Kimyasal Tepkimelerde Hız 3 YouTube
1. Basınç-Hacim 2. Renk 3. İletkenlik gibi fiziksel özelliklerin değişimi tepkimenin gidişatı hakkında bilgi verir. ÖRNEK: Hem basınç hem de hacim artış veya azalmasıyla tepki- me hızı izlenebilir. Mg + 2HCl (suda) Æ MgCl2 (suda) + H2 (g) (Gaz çıkışı) N2 (g) + 3H2 (g) Æ 2NH3 (g) (Basınç azalması) C2H4 (g) + Br2 (suda) Æ C2H4Br2 (g) (Renk takibi)

Tepkime Hızı Ölçülmesi Kimya Ayt Konu Anlatımı
Orbital Yayınları

KİMYASAL TEPKİMELERDE HIZ1 Ortalama Hız Hız Takibi Yöntemleri Konu Anlatımı Soru Çözümü11.Sınıf
Google Classroom Kimyasal tepkime nedir? Tepkimeler atomlar arasındaki bağı nasıl bozarlar veya oluştururlar? Dengede olan tepkimeler, tersinirlik ve denge kavramları. Giriş Tüm moleküller, vücudumuzu oluşturanlar da dahil, kimyasal bağlarla bir arada tutulan atomlardan meydana gelirler.

AYT Kimya 11. Sınıf Ders İşleyiş Modülleri Modül6 Kimyasal Tepkimelerde Hız Nesibe Aydın
Kimyasal tepkimelerde hız ifade edilirken madde miktarındaki değişim genelde mol veya molarite ile ifade edilir. Kimyasal tepkimelerde hız tepkimeye giren maddelerin özelliklerindeki değişimler izlenerek ölçülebilir. Örneğin renk, basınç, hacim, iletkenlik gibi değerlerdeki değişimlerden hız ölçülebilir. 1. Çarpışma Teorisi